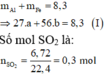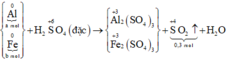Cho m gam hỗn hợp 2 kim loại Al và Cu chia làm 2 phần bằng nhau :
- Phần 1 : Cho tác dụng với dung dịch H 2 SO 4 loãng, dư thu được 1,344 lít khí H 2 (đktc).
- Phần 2 : Cho tác dụng với dung dịch H 2 SO 4 đặc nóng, dư, thu được 2,24 lít khí SO 2 (đktc) .Xác định giá trị của m.